
1.实验原理
查阅有关标准电极电位[19]的资料知:Eθ(Ag+/Ag)=0.7995 V,Eθ(I2/I-)=0.536 V,说明AgNO3溶液与KI溶液混合可以发生Ag+氧化I-的反应过程,得到I2和Ag;但AgNO3溶液与KI溶液不管怎样混合,都是得到AgI沉淀。这是由于两种溶液混合后得到AgI沉淀,使得溶液中的Ag+或I-浓度显著降低[注Ksp(AgI)=9.7×10-17],显著降低了Ag+或I-的氧化性或还原性,最终这两种离子之间就难以发生氧化还原反应了。从动力角度看,氧化还原反应的反应速率远慢于沉淀反应速率,最终导致Ag+无法氧化I-是很容易理解的。设法降低沉淀反应的反应速率似乎难以做到,若人为阻断Ag+与I-的接触就可把沉淀反应速率降低到0,一种可行的方法是设计(-)石墨(s)|I-(aq)||Ag+(aq)|石墨(s)(+)原电池(使用盐桥阻断Ag+与I-的相互接触)来完成,通过观察到的实验现象以及相应的空白实验现象,分析并得出结论:Ag+可以氧化I-,反应的离子方程式为![]() 。
。
通过设计(-)石墨(s)|I-(aq)||Ag+(aq)|石墨(s)(+)原电池,记录电压表读数。当向KI溶液中加入AgNO3溶液时,由于发生沉淀反应,降低了I-浓度,电池电势差减小,电压表指针变小;当向KI溶液中继续加入NaCl固体,由于增大了c(Cl-),可使![]() 向正向移动,增大c(I-)浓度,电池电势差增大,电压表指针变大。因此可以通过观察电压表读数变化判断AgI(s)+Cl-
向正向移动,增大c(I-)浓度,电池电势差增大,电压表指针变大。因此可以通过观察电压表读数变化判断AgI(s)+Cl-![]() 转化的发生。
转化的发生。
2.实验步骤
(1)取两个洁净的烧杯,向其中一个烧杯中加入1 mol/L AgNO3溶液20 mL,另一个烧杯中加入1 mol/L KI溶液20 mL,将两个石墨电极连接于导线两端并连接电压表(量程为0~3 V),然后将两电极分别插入两个烧杯中,并同时插入浸有KNO3的盐桥,如图4-5-1所示。观察并记录电压表读数。一段时间后取KI溶液少量,滴加淀粉,观察现象。
(2)向盛有KI溶液的烧杯中不断加入1 mol/L AgNO3溶液,至不再产生黄色沉淀为止,观察并记录电压表读数,如图4-5-2所示。
(3)再向盛有KI溶液的烧杯中加入NaCl固体,观察并记录电压表读数,如图4-5-3所示。
(4)将原盛放KI溶液的烧杯换成盛放饱和NaCl溶液的烧杯,观察并记录电压表读数,如图4-5-4所示。

图4-5-1 实验装置

图4-5-2 实验装置(www.zuozong.com)

图4-5-3 实验装置

图4-5-4 实验装置
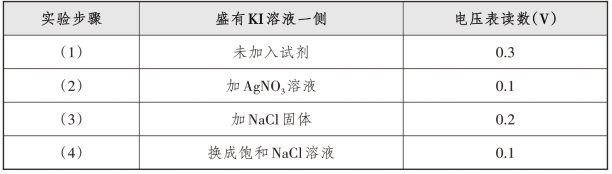
3.实验数据
实验相关数据如表4-5-1所示。
表4-5-1 实验及电压表读数
说明:本实验中产生的电流比较微弱,由于我校实验条件有限,电压表量程最小只有3 V,所以观察到电压表指针变化不是特别明显,若用灵敏度较高的数字电压计或量程更小的电压表,指针变化则会更明显。
4.实验结论分析
AgNO3溶液和KI溶液存在电势差,放置在不同的区域中,用盐桥组成原电池,电压表指针发生偏转(读数为0.3 V),当向KI溶液中加入AgNO3溶液至不再产生沉淀,由于c(I-)减小,还原性减弱,电势差减小,电压表指针变小(读数为0.1 V);当向AgI悬浊液中加入NaCl固体,由于存在![]() 平衡,增大c(Cl-),使c(I-)增大,还原性增强,电势差变大,电压表指针变大(为0.2V);由于加入NaCl固体,增大了溶液中的离子浓度可能会增大电流强度,于是设计了对比实验,用饱和的NaCl溶液代替AgI悬浊液和NaCl饱和溶液,排除其干扰(测其读数为0.1 V)。由此实验可以实现AgI沉淀向AgCl沉淀转化的实验观察。
平衡,增大c(Cl-),使c(I-)增大,还原性增强,电势差变大,电压表指针变大(为0.2V);由于加入NaCl固体,增大了溶液中的离子浓度可能会增大电流强度,于是设计了对比实验,用饱和的NaCl溶液代替AgI悬浊液和NaCl饱和溶液,排除其干扰(测其读数为0.1 V)。由此实验可以实现AgI沉淀向AgCl沉淀转化的实验观察。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




