
1.实验设计原理分析
硝酸银溶液检验氯离子,利用的是反应![]() ,根据产生的白色AgCl沉淀进行鉴别。由于AgCl在水溶液中的溶解度比较小,在常温下Ksp=1.8×10-10,用该沉淀检验的灵敏度较高,比如10 mL Cl-浓度为0.00001 mol/L的溶液中,滴入2滴1 mol/L的硝酸银溶液(每滴按照0.02 mL计算),则有:
,根据产生的白色AgCl沉淀进行鉴别。由于AgCl在水溶液中的溶解度比较小,在常温下Ksp=1.8×10-10,用该沉淀检验的灵敏度较高,比如10 mL Cl-浓度为0.00001 mol/L的溶液中,滴入2滴1 mol/L的硝酸银溶液(每滴按照0.02 mL计算),则有:
c(Cl-)=0.00001 mol/L;c(Ag+)=0.01 mol/L
c(Cl-)×c(Ag+)=0.00001×0.01=10-7>Ksp=1.8×10-10
根据计算可以看出,即使Cl-浓度为0.00001 mol/L,仍然能够用该法检出Cl-,灵敏度高。于是,主要矛盾集中在干扰离子的排除。Ag+与常见阴离子如OH-,CO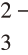 ,SO
,SO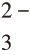 等都能形成沉淀,成为Cl-检验的干扰,引入稀硝酸可排除这些离子的干扰。
等都能形成沉淀,成为Cl-检验的干扰,引入稀硝酸可排除这些离子的干扰。
针对教材和流行试题中出现的稀硝酸和硝酸银溶液滴加顺序的争议,笔者直接设计干扰离子溶液,以中学常见的离子![]() 为研究对象,配制对应的钠盐溶液与稀硝酸和硝酸银溶液在不同顺序下反应,观察生成沉淀的溶解情况。如果最后得到澄清溶液,说明能够排除干扰;如果最后有沉淀不能完全溶解,就会对氯离子的沉淀形成干扰,视为不能排除干扰。
为研究对象,配制对应的钠盐溶液与稀硝酸和硝酸银溶液在不同顺序下反应,观察生成沉淀的溶解情况。如果最后得到澄清溶液,说明能够排除干扰;如果最后有沉淀不能完全溶解,就会对氯离子的沉淀形成干扰,视为不能排除干扰。
2.实验设计及操作
(1)实验试剂。
新配制浓度分别为0.1 mol/L的NaOH溶液、Na2CO3溶液、Na2SO4溶液、Na2SO3溶液、Na2S溶液,新配制浓度分别为1.0 mol/L的AgNO3溶液、稀硝酸。(www.zuozong.com)
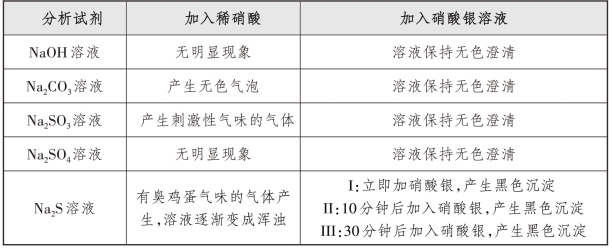
(2)实验1:先加稀硝酸,再加硝酸银溶液。
取5支试管,分别取1 mL NaOH溶液、Na2CO3溶液、Na2SO4溶液、Na2SO3溶液、Na2S溶液。用胶头滴管分别向5支试管中加稀硝酸,用pH试纸检验溶液为酸性后,再滴加10滴硝酸银溶液(对于Na2SO4溶液,稀硝酸加入10滴),实验结果如表4-3-1所示。
表4-3-1 先加稀硝酸,再加硝酸银溶液实验结果
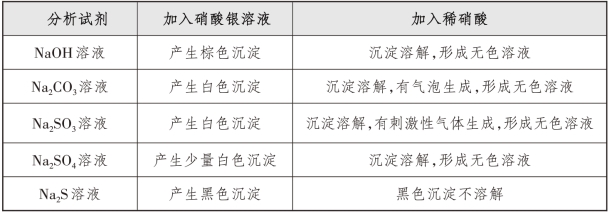
(3)实验2:先加硝酸银溶液,再加稀硝酸。
取5支试管,分别取1 mL NaOH溶液、Na2CO3溶液、Na2SO4溶液、Na2SO3溶液、Na2S溶液。用胶头滴管分别向5支试管中滴加10滴硝酸银溶液,再加稀硝酸,直至沉淀溶解完全,或者沉淀不再变化。实验结果如表4-3-2所示。
表4-3-2 先加硝酸银溶液,再加稀硝酸实验结果
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




