
从以上分析可以看出,初、高中化学教材和教学目标要求的不同,正是从化学学科特点和学生的认知发展规律进行的合理安排,因此在教学中应该遵循认知发展规律进行教学,在初中阶段做好认知发展的准备,而高中阶段的教学应该关注初中的认知基础,以促进初、高中教学衔接,具体分析如下。
1.初中教学应以思维培养为主要目的,做好认知发展准备
目前的初中化学仅在初三开设,由于教学时间短,又面临压力较大的中考,不少教师并未从学生认知发展的角度出发进行教学,而是以中考考试要求为教学指导。同时部分初中教师本身对学生的认知发展缺乏正确的理解,在处理一些知识的时候,过于简单和绝对,阻碍了学生的认知发展。就像前文分析的复分解反应原理的教学,仅从“生成水、沉淀或气体”的简单规则进行教学。
同样,笔者在教学中发现,不少高中学生很难掌握元素的化合价,特别是在高一刚开始学习氧化还原反应时,需要学生能够分析元素的化合价。而不少学生仅仅能够标注常见物质中元素的化合价,对于稍微陌生的物质的化合价则不会处理,也不能将电子得失与化合价变化联系起来,从而导致氧化还原反应学习困难。如在完成以下例题时出现困难。
例题:Na+、S2-、S、Na2O2、H2S五种微粒中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
由于学生不知道元素的可能价态,则不能分析各物质的可能性质。究其原因,是他们学习化合价时并未从化合价的本质出发进行学习,而是按照规律记住常见元素的化合价,如:正一铜氢钾钠银,正二铜镁钙钡锌;三铝四硅四六硫,二四五氮三五磷;一五七氯二三铁,二四六七锰为正;碳有正四与正二,再把负价牢记心;负一溴碘与氟氯,负二氧硫三氮磷。
这样的教学有利于快速掌握常见物质中元素的典型化合价,甚至能在初中阶段的考试中得到好成绩。但是通过这些记忆取得的好成绩,并不能代表学生对化合价本质原理已经掌握透彻。实际上在遇到较为陌生的物质,或者是需要全面考虑元素化合价的时候就不知所措,更不能将电子转移和化合价有机联系起来。
正确的教学应该是引导学生分析化合价的本质原理。在初中阶段,学生已经掌握了常见元素的原子结构,能够书写常见元素的原子结构示意图,掌握了最外层8(2)电子结构的稳定规则。在此基础上通过原子结构和电子得失来认识化合价是完全可行的。
比如Na在化合物中为什么是+1价?是因为它最外层只有1个电子。失去这1个电子,就变成8电子的稳定结构,形成+1价的Na+;同理可以分析S元素最低为-2价,最高为+6价。这样就逐渐理解了化合价的本质,以此可以分析和解决一些新的问题。针对上面的例题,就能够分析得到Na+中Na元素已经达到最高价,只具有氧化性;S2-中S元素为最低价,在化学反应中如果要改变化合价,化合价只能上升,因此S2-只具有还原性。这就将化合价和电子转移联系起来,为学习氧化还原反应提供了思维基础。
同样,在催化剂的教学中,笔者发现不少高中学生对于催化剂的认识存在误区,他们只知道催化剂可以改变化学反应速率,而不知道也没有意识去研究催化剂作用的原理。在高中化学教材中,对催化剂的广泛性和作用原理有进一步的介绍。而很多学生视而不见,重要的原因在于初中教学中没有考虑到高中阶段的认知发展情况,仅仅让学生记住催化剂改变速率的事实。
在初、高中衔接的教学中,这样的内容还比较多,如燃烧概念,物质组成等知识的学习,初中学习的知识都不能体现化学本质的全部内容,对这些知识的理解在后续学习中还要进一步发展。教师在教学过程中,应尊重和满足学生发展的需要,转变只为完成课堂目标,将学生思维的触角随意掐断,将学生的思维禁锢在狭小空间中的教学模式,应力图使教学中斩钉截铁的句号变为浮想联翩的省略号[62]。为思考而教,为发展而教,应该成为常态化的教学方式。(www.zuozong.com)
2.以学生的已有认知为基础进行高中教学,实现认知持续发展
已有知识与新信息之间联系的必然性不仅是皮亚杰理论也是当代认知学习的重要理论。按照该理论,学习主要是顺应的结果,即修改原有图式或形成新图式[63]。由于初中阶段学生已经进行了化学学习,形成了一定的化学知识和观念,高中教学应在初中已有认知的基础之上形成新的认知。因此在高中化学教学中,要了解学生已有的认知状况,分析新旧知识之间的联系,引导学生实现新旧知识之间的转化,建立新认知。
以氧化还原反应的学习为例,初中阶段从得失氧的角度来认识氧化还原反应,高中阶段在此基础上进一步拓展,从化合价的变化和电子转移的角度来认识氧化还原反应。在进行高中阶段教学的时候,不要一味地认为初中阶段的认识方式简单,抛弃初中已经形成的认知基础,而应该正确认识初、高中知识之间的联系。分析初、高中的知识发现,初中阶段从得失氧的角度来认识氧化还原反应,正是高中阶段用化合价和电子转移认识氧化还原反应的特例,高中阶段的学习正是将特殊情况向一般情况推广的过程。
基于此,高中教学就应该在初中已有的认知基础上进行拓展。笔者在教学中发现,初学氧化还原反应原理时,从化合价变化或者电子得失的观点掌握氧化剂、还原剂、氧化性、还原性等概念时非常容易引起混淆。如果一味地要求学生从这样的角度去掌握氧化还原反应则很困难。既然如此,在进行教学的时候,应该借助初中已有的概念来进行高中阶段的学习。
笔者在教学中借助初中典型的氧化还原反应![]() 来认识氧化还原反应的新观念。学生通过初中的学习,已经掌握了H2为还原剂,CuO为氧化剂。而高中的化学学习中,H2仍然是还原剂,CuO仍然是氧化剂,它们分别显还原性和氧化性的特点也没有改变,只是改为从化合价与电子得失的观点分析。反应中H2中H元素化合价升高,失去电子。以此推广,化合价升高,失去电子就是还原剂的特征。
来认识氧化还原反应的新观念。学生通过初中的学习,已经掌握了H2为还原剂,CuO为氧化剂。而高中的化学学习中,H2仍然是还原剂,CuO仍然是氧化剂,它们分别显还原性和氧化性的特点也没有改变,只是改为从化合价与电子得失的观点分析。反应中H2中H元素化合价升高,失去电子。以此推广,化合价升高,失去电子就是还原剂的特征。
此时再结合化合价的原理来分析化合价变化和电子得失情况,对学生掌握物质的氧化性和还原性具有重要的促进作用。以前文讨论的Na为例,从原子结构来看,Na原子最外层只有1个电子,非常容易失去一个电子形成+1价的Na+,因此Na具有典型的还原性。这样的学习,相当于运用初中的原子结构的知识来学习高中的新问题,实现了初、高中知识的合理衔接。
在复分解反应原理的学习中,初中的“水、淀、气”判断标准中的“水、气”实际上是形成弱电解质的特殊形式。为了促进学生对复分解反应原理的掌握,在高中学习强弱电解质概念之后,应该设计针对性教学,促使学生对复分解反应原理建立新的认识。
在教学中让学生分析:为什么生成水可以发生反应?学生通过分析发现,溶液中如果有H+和OH-,反应中结合生成水,实质在于水是弱电解质。由于水是弱电解质,H+和OH-形成水之后,不能完全电离成H+和OH-,体系中产生新产物水,新的反应就发生了。从而引导学生认识到能够形成弱电解质的反应就可能发生。如CH3COO-与H+结合生成CH3COOH,也由于CH3COOH是弱电解质,即溶液中有大量的CH3COO-和H+时,就会结合生成CH3COOH,同样由于CH3COOH是弱电解质不能完全电离成CH3COO-和H+,最终生成了新物质CH3COOH,完成反应:
生成“气体”能够反应又是什么原因?笔者引导学生从碳酸钠与盐酸反应生成二氧化碳气体进行分析。碳酸钠与盐酸反应,其实质就是C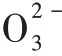 与H+先形成弱电解质H2CO3,而H2CO3不稳定,分解产生二氧化碳,即:
与H+先形成弱电解质H2CO3,而H2CO3不稳定,分解产生二氧化碳,即:
通过类似针对新旧知识的分析,促进学生将已有认知向新观念转变。学生逐渐认识到,按照“生成水、沉淀或气体”作为判断反应的原理,只是直观和片面的方式,而新的观念是对已有认知的进一步提升,更能够体现出反应实质,应用更加广泛,分析到此,学生就会将新旧知识进行结合,完成新旧迁移,促进新知建构。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




