
按照建构主义的观点,学习是一个连续的过程,任何学习都是在学习者已经具有的知识经验和认知结构、已经获得的动作技能、已经习得的态度等基础上进行的[3]。复分解反应原理的学习也是一样,第一阶段的认知是第二阶段和第三阶段认知的基础,因此学生的“首因效应”是教学的优势。同时,也应该考虑到首因效应对认知发展的阻碍作用,在复分解反应原理教学中,也要充分重视首因效应带来的认知困境,分析学生心理认知特点,采取适当的对策,促进学生对反应原理的认识逐步提高,认识本质。
1.分析新旧知识,促进正向迁移
从前文分析知道,学习了元素、化合物后,由于学习和研究的化学反应增多,对复分解反应原理的认识进入第二阶段。相比第一阶段,思维抽象性增加,此时不再限于从“生成沉淀、气体或水”的直观现象判断反应的发生,对反应的认识要发展到根据溶液中的离子浓度变化进行判断的能力水平,如CH3COO-和H+反应生成CH3COOH类型的反应。对于新问题的出现,如果不进行重点分析,学生的认知水平就会停留在已有基础上,不能适时提升;此时应该着重分析新、旧知识的联系,促使前后知识正向迁移。
如分析CH3COO-和H+反应生成CH3COOH的原理时,可以借助于第一阶段的认识,重新分析“水”的生成。
为什么生成水可以发生反应呢?让学生思考这个问题。学生通过分析发现,溶液中如果有H+和OH-,它们结合生成水,由于水是弱电解质,一旦形成,就不能完全电离生成H+和OH-,这样一来,体系中就出现了新产物“水”,这就是化学反应发生的本质。接着类比分析CH3COO-与H+的情况,CH3COO-与H+相遇结合生成CH3COOH,也由于CH3COOH是弱电解质,不能完全电离成CH3COO-和H+,就相当于生成了新物质CH3COOH,完成了反应:![]() 。
。
通过这样的分析,学生在第一阶段认知的基础上,将已有认识变成了新认识,对知识进行了有效迁移,使得学生对于复分解反应原理的认知上升到第二阶段。
由于首因效应的影响强烈,在教学过程中,应该寻找机会,抓住新旧知识联系的窗口,让学生对新观念进行理解和应用,促进学生认知的转化和巩固。比如学生对NH4+与OH-反应产生氨气的反应比较熟悉,因为该反应用来检验NH4+的存在。如何认识该反应原理呢?如果仍然按照产生气体进行解释,相当于是对“水、淀、气”原理的强化,失去了建构新知识的机会。有效的教学措施,应该抓住这类新旧知识联系的契机,利用新原理分析反应,促进新观念合理迁移和强化。
笔者在分析NH4+与OH-的反应原理时,引导学生用形成弱电解质的原理去理解反应。在分析中,让学生认识到,该反应在加热条件下,或者浓溶液时会反应产生NH3,而此时的反应根本原理却不是由于产生了氨气,而是由于NH3·H2O是弱电解质,NH4+与OH-相遇即反应生成NH3·H2O。这个反应在不加热或者比较稀的溶液中,也能够发生,且此时产物为NH3·H2O,并没有气体和水生成。加热或者浓溶液情况下之所以产生NH3,原因在于NH3·H2O不稳定,发生后续的分解反应。
通过类似针对新旧知识的分析,促进学生将已有认知向新观念转变。学生逐渐认识到,第一阶段按照“生成水、沉淀或气体”作为判断反应的原理,只是直观和片面的方式,而新的观念是对已有认知的进一步提升,更能体现出反应实质,应用也更加广泛。分析到此,学生就会将新旧知识进行结合,完成新旧迁移,促进新知建构。
2.引发认知冲突,促进观念更新
认知冲突是个体已有观点与新的问题情境相互矛盾而产生的一种心理不平衡,是学习者已建立的认知结构与当前面临的情境之间暂时的矛盾与冲突,是已有的知识和经验与新知识之间存在某种差距而导致心理失衡的一种认知状态。认知冲突过程要发生,必须具备:(1)意识到反常情境;(2)对要解决的认知冲突表现出兴趣或焦虑;(3)积极进行认知再评价[4]。在化学教学中,可以利用实验事实,让学生面对与先前经验不一样的,甚至完全相反的实验现象,引发学生的认知冲突。在形成认知冲突之后,引导学生进行分析、思考和探索,促进新知识的学习和新观念的形成。
如前文分析,学生认为CO2通入CaCl2溶液,会产生CaCO3沉淀。原因在于其认识停留在第一阶段——根据“生成水、沉淀或气体”判断反应的发生。于是学生对反应进行分析,认为CO2溶于水形成H2CO3,H2CO3电离出![]() 与Ca2+形成CaCO3沉淀,符合生成沉淀的要求,反应即发生;同理,BaSO3难溶于水,SO2通入BaCl2溶液也可以产生BaSO3。面对这样的情境,与其进行理论上的争论,不如先给学生实验事实,让学生形成认知冲突,进而思考和理解新问题,实验设计如表2-1-2所示。
与Ca2+形成CaCO3沉淀,符合生成沉淀的要求,反应即发生;同理,BaSO3难溶于水,SO2通入BaCl2溶液也可以产生BaSO3。面对这样的情境,与其进行理论上的争论,不如先给学生实验事实,让学生形成认知冲突,进而思考和理解新问题,实验设计如表2-1-2所示。
表2-1-2 复分解反应原理探究
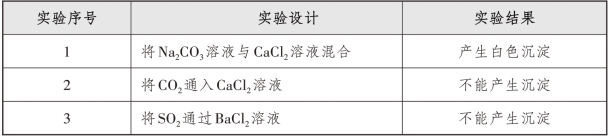
实验1符合学生的预期,而实验2和3出现了异常,这样的认知冲突,促使学生重新审视已学的复分解反应原理,进行新问题的分析。
通过分析,学生逐渐认识到所谓“生成沉淀”,要考虑这个沉淀能不能在反应后的体系中存在,“千方百计”组合出来的沉淀,在反应体系中如果不能稳定存在,就不能发生反应。如将Na2CO3溶液与CaCl2溶液混合生成的CaCO3沉淀在反应体系中能够存在,反应可行;而CO2通入CaCl2溶液,反应的混合物中本身并不存在大量的碳酸根,不能与钙离子形成沉淀,非要认为CO2通入水中形成碳酸,碳酸电离产生碳酸根,从而与钙离子形成沉淀,但同时产生的盐酸,又将碳酸钙沉淀溶解,故无沉淀生成。
通过这些认识,不少学生能够判断CO2通入CaCl2溶液等同一类型的反应,并且总结出“弱酸不能制备强酸”的反应判断原则,甚至不少教师在教学中也使用这个总结。显然这个总结也不是复分解反应原理的本质,处于第二阶段时这样认识尚可,对复分解原理的认识最终应该发展到第三阶段,即用化学平衡的原理来判断反应进行的方向。
因此,在学习电离平衡及溶解沉淀平衡之后,应该用平衡原理来认识CO2通入CaCl2溶液的反应。按照溶解沉淀平衡原理,能否生成CaCO3沉淀,要根据溶液中存在的c(CO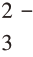 )与c(Ca2+)的乘积是否大于CaCO3的Ksp。为了改变“弱酸不能制备强酸”的观点,建立第三阶段认知,以CuS的形成为例,设计了如表2-1-3所示实验。
)与c(Ca2+)的乘积是否大于CaCO3的Ksp。为了改变“弱酸不能制备强酸”的观点,建立第三阶段认知,以CuS的形成为例,设计了如表2-1-3所示实验。
表2-1-3 生成CuS沉淀的实验设计

Na2S溶液与CuSO4溶液混合产生CuS沉淀,在学生的已有观念之中,而H2S通入CuSO4溶液也产生黑色沉淀(显然也是CuS),与“弱酸不能制备强酸”的规则矛盾,激起学生的认知冲突。于是,笔者提供数据,根据《化学反应原理》(选修4)第65页给出的数据:Ksp(CuS)=6.3×10-36。同时,给出室温下,H2S饱和水溶液中,c(H2S)=0.1 mol/L,电离出的c(S2-)=1.2×10-15 mol/L[5],引导学生利用Ksp的原理来认识反应,解决该认知冲突。过程如下:
(1)浓度分别为0.2 mol/L的Na2S溶液与CuSO4溶液等体积混合时:
c(S2-)×c(Cu2+)=0.1×0.1=10-2>Ksp(CuS)=6.3×10-36
(2)H2S通入0.1 mol/L的CuSO4溶液时,按照H2S饱和溶液计算:(www.zuozong.com)
c(S2-)×c(Cu2+)=1.2×10-15×0.1=1.2×10-16>Ksp(CuS)=6.3×10-36
根据计算结果,两种情况都能发生反应,正确地解释了实验事实。通过对认知冲突的解决,学生确立了利用化学平衡的思想来认识复分解反应的意识,认知进入第三阶段。
3.开放探究情境,加深本质认识
布鲁纳认为,学习的过程就是一个探索知识的过程。科学的核心是探究,科学探究的过程就是解决问题的过程[6]。在教学中,为了让学生进一步理解科学本质,引导学生通过猜想假设、分析论证、类比推理的方式主动建构模型,以培养学生的批判质疑思维和在陌生情境中解决问题的能力[7]。而学生在复分解反应原理的学习中,之所以会出现典型的认知困境,很大程度上在于学生掌握了第一阶段的原理之后,就认为已经掌握了本质原理,失去了进一步探索的动机,使得其认知水平停滞不前。为此,教师应设置开放的问题情境,让学生通过各种问题的解决,发现已有知识的局限,促进新知识的认识和应用,从而更新观念,逐渐认清本质。
如学生对复分解反应原理的认知水平发展到第二阶段之后,笔者跟踪性地设计提出了几个探究问题。
【探究1】(1)将SO2通入BaCl2溶液中是否有沉淀?
(2)分别向(1)形成的混合物中通入NH3、Cl2,探究反应情况,并书写方程式。
(3)总结使(1)形成的溶液得到含钡沉淀的方法。

理论分析之后,学生设计实验进一步探究,得到与理论分析一致的结论。


通过此类探究,学生对SO2通入BaCl2溶液的反应情况进行了较为全面的分析,从而促进学生透过现象去分析反应的本质原理。
同样,当学生的认识达到第三阶段,需要运用平衡原理来判断反应情况时,笔者结合学生对苯酚酸性问题的困惑,设计如下探究问题。
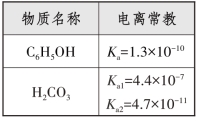
【探究2】已知苯酚与碳酸在室温下的电离常数,请探究下列反应的原理。
(1)苯酚与碳酸钠溶液的反应;
(2)将过量CO2通入苯酚钠溶液;
(3)将少量CO2通入苯酚钠溶液。
学生通过实验探究及电离常数的关系:Ka1(H2CO3)=4.4×10-7>K(C6H5OH)=1.3×10-10>Ka2(H2CO3)=4.7×10-11,得出苯酚与碳酸钠溶液反应生成苯酚钠和碳酸氢钠,反应原理为:
C6H5OH+Na2CO3→C6H5ONa+NaHCO3
无论是少量的CO2还是过量的CO2,通入苯酚钠溶液都生成碳酸氢钠,反应原理为:
C6H5ONa+CO2+H2O→C6H5OH+NaHCO3
通过对该问题情境的探究,学生对苯酚的酸性问题有了深入了解,也体会到了电离常数对复分解反应原理分析中的作用,促进学生对复分解反应的认识逐步向第三阶段发展,逐渐理清了复分解反应发生的本质。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




