
1.铬的基本性质
铬是一种带有青光的银白色金属。1797年法国化学家沃克兰从铬铅矿中分离出铬的氧化物。单质金属铬在1854年由本生制得。
铬元素符号为Cr,在元素周期表中排序为41位,相对原子质量为51.996,原子价态有+2、+3和+6价,其中以+3价和+6价最为常见。例如镀铬溶液中的铬酐为+6价,三氯化铬中的铬为+3价。铬的标准电极电位为-0.56V,其电化学当量为0.3234[g/(A·h)]。金属铬的硬度较高,一般为750~1050HV,铬金属的熔点为1890℃,密度为6.9~7.1g/cm3。
2.镀铬的用途与电镀史
镀铬的历史距今已有160余年。1854年Bunsen第一个发明了采用三价铬的镀铬溶液。两年后Genther从六价铬溶液中获得了金属铬镀层。但这些技术只停留在研究方面,而真正获得具有工业价值的镀铬技术是在1925年由Sargent等人提出的所谓Sargent镀液:铬酐250g/L,硫酸2.5g/L,这正是至今仍在使用的标准镀铬溶液。
1925年后,镀铬研究十分活跃,研究人员相继发表了松孔镀铬、微裂纹镀铬、镀黑铬以及以硅氟酸为催化剂的复合镀铬技术。自动控制镀液的技术也得以发展。为了减少公害,以利于环保,还先后开发了低浓度镀铬技术及使用氟碳表面活性剂抑制铬雾的新材料。为提高电镀铬的沉积速度,还开发了可以使用大电流的镀铬技术。
为了降低镀硬铬的生产成本,在提高电流效率上,美国安美特化学有限公司在1984年成功开发出HEET工艺。该镀液为不含氟的高电流效率镀铬工艺,将电流效率由传统标准镀铬的12%提高了一倍,达到25%~27%,为电镀硬铬节省了大量电能。因为硬铬的成本主要是电。
为了从根本上解决六价铬的危害,人们一直在尝试着三价铬电镀技术的研究。近年来进展加快,据报道国内有些公司已推出了一些性能较好的专利产品,并部分已投放市场。
铬镀层在大气条件下与空气中的氧生产钝态的氧化铬膜,这种膜很不活泼,但没有体积上的变化,使基体不再遭受腐蚀,并能保持它原有的光泽。所以铬镀层常被用来作装饰性防护镀层的表层。例如在光亮镍上镀一层0.2~0.5μm的铬就能保证镀层光泽不变,而光亮镍层则会逐渐变成暗色。
铬镀层的硬度很高,耐磨性能优异,常用作耐磨镀层,如在矿山液压支架、轴类、模具气缸内壁镀铬以增加耐磨性能,延长这些零件的使用寿命。
铬镀层经过特殊处理后,可以获得某些特种功能,如内燃机气缸内壁上镀一层带有很多微孔或微裂纹的铬镀层,这些微孔和微裂纹中可以储存润滑油,提高了它的减摩能力,大大延长了气缸的使用寿命。在镀铬溶液中加入某些化合物就可镀出黑色铬层,这在太阳能行业、照相机行业、光学仪表仪器行业都有广泛用途。
铬的反光能力介于银(88%)和镍(55%)之间。而银在空气中极易与硫化氢气体(大气中含有此气体)形成黑色的硫化银,而镍在大气中也会与氧气接触氧化成氧化镍而失去光泽,所以常用镀铬层作反光镜。镀铬在工业及日常生活中的应用十分普遍。
3.镀铬的特点及镀液类型
(1)镀铬的工艺特点 与其他工艺相比,镀铬工艺具有如下特点:
1)阳极不使用金属铬,而是使用铅合金,如铅锑合金、铅锡合金。这些合金在施镀过程中不溶解,所消耗的主盐需单独补加。
2)电流效率低,一般标准镀铬(以硫酸根为催化剂)的电流效率仅为12%~14%。即使是加有添加剂的镀液也只能达到25%~27%,电能大部分消耗于析氢负反应。
3)电镀过程中,电流密度取决于镀液温度,几乎与主盐浓度无关。
4)镀液的均镀能力和覆盖能力很低,在生产中要使用辅助阳极或辅助阴极才能获得合格的镀层。
5)镀液成分简单,但主盐浓度使用范围很宽。
6)在镀硬铬时,对基体金属的前处理要求严格,有时还要做特殊处理。
(2)镀液类型 镀铬溶液要根据镀铬层的用途不同而改变,主要分为下述几种:
1)装饰-防护性镀铬溶液,如标准铬(CrO3250g/L,SO42-2.5g/L)。
2)镀硬铬溶液。
3)微孔铬或微裂纹铬溶液。
4)镀黑铬溶液。
近年来,由于六价铬对环境的影响太大,人们开始研究毒性及污染更小的三价铬镀铬溶液,已有所进展。
三价铬镀铬工艺具有明显的优点:电流效率明显高于六价铬镀铬;可以常温使用(生产);镀液的毒性较六价铬明显降低。但三价铬镀液稳定性差,需要特殊稳定剂以防止在阳极上三价铬被氧化成六价铬,造成缺陷。
4.镀铬机理
普通标准镀铬的基本工艺规范:
铬酸酐 250g/L
硫酸2.5g/L
三价铬2~7g/L
温度50±5℃
电流密度10~50A/dm2
阳极铅锑合金
从上述配方中我们看到,镀液成分只有两种:铬酸酐和硫酸。三价铬是电镀时在阳极上自然产生的。先讨论铬酸酐在镀液中的行为。
(1)铬酐 铬酐进入水中马上溶解变成水溶液。它在溶液中的形态与铬酐的浓度有关。当铬酸酐浓度较高时,铬酐与水作用后形成四铬酸或三铬酸:
4CrO3+H2O→H2Cr4O13(四铬酸)
3CrO3+H2O→H2Cr3O10(三铬酸)
当铬酸酐的浓度一般时,它与水形成重铬酸或铬酸:
2CrO3+H2O→H2Cr2O7(重铬酸)
CrO3+H2O→H2CrO4(铬酸)
当铬酸浓度很低时,会形成铬酸氢根:
Cr2O+H2O→2HCrO4-
在电镀铬时,铬酸酐的浓度为200~400g/L。所以六价铬大多以H2Cr2O7或H2CrO4的形式存在。实际上,在镀液中,重铬酸与铬酸存在着下述平衡关系:
2H2CrO4⇌H2Cr2O7+H2O4-
从上述关系式中不难看出:当镀液中铬酸浓度增加时平衡向右移动,即向生成重铬酸的方向移动;当铬酸浓度减少时,平衡又会向左移动,即向生成铬酸的方向移动。
由于水是中性的,所以水的增加必然会使镀液的pH值增加(升高)。所以六价铬离子的形态与pH值有关,当pH值上升时,六价铬离子以铬酸(H2CrO4)形态为主,当pH值下降时,则以重铬酸形态为主,方程式如下:
2H2CrO4→H2Cr2O7+H2O
(2)催化剂 生产实践证明,在仅有铬酐的溶液中是不能获得镀层的,还必须含有少量阴离子,如SO24-、F-1等。这些阴离子称为催化剂,阴离子以硫酸根应用最为广泛。只要含有SO24-的化合物均可担当此任。硫酸使用最多,这是因为除了SO42-和H+离子外,不会引入其他离子,但硫酸锶却例外。这是因为硫酸锶的溶解度非常小,它的溶解度正好符合镀铬工艺要求,在生产中当镀液中的硫酸根因带出而减少时,硫酸锶就会自动溶解出硫酸根,以保证镀铬溶液中硫酸根浓度保持恒定。所以使用硫酸锶的镀铬溶液常称为自动调节镀铬液。
催化剂还有氟化钠、氟硅酸或氟硅酸钾。含氟镀液与含硫酸根的镀液相比具有下述优点:
1)镀液可以使用较低的铬酸酐浓度,减少带出损失,并降低配槽成本。
2)可以使用较高的电流密度,以提高电镀速度。
3)具有较高的电流效率,节省电能,提高生产效率。
4)具有较高的均镀能力和覆盖能力。(www.zuozong.com)
但是,含氟镀铬液也有下述不足之处:
1)对槽底、衬层有较强腐蚀作用。对形状复杂的镀件小电流区也有腐蚀作用。
2)需使用含锡铅合金作阳极,成本加大。
3)对铁杂质敏感,且不易去除。
(3)三价铬离子 在上述配方中,三价铬离子也很重要。在镀槽中加入水、铬酐和硫酸后,通电伊始,并没有铬被镀出来,而只见大量气体冒出来,但开始一段时间后,在阴极上便慢慢地出现了铬镀层。这是因为在电镀时,六价铬离子跑到阴极表面上发生了还原反应:
Cr6++3e→Cr3+
六价铬在阴极(镀件)表面获得3个电子形成了三价铬离子,在三价铬离子的作用下,六价铬才能发生下述还原反应:
Cr6++6e→Cr
这时铬就被镀出来了,与此同时三价铬离子运动到阳极表面时,会发生氧化反应:
Cr3+-3e→Cr6+
为了尽量减少这一反应发生,应在镀槽上加大阳极面积,同时缩小阴极面积,使生成三价铬的离子数量大于减少三价铬离子的数量,就能保证镀液中有一定浓度的三价铬离子。生产中也经常使用此方法(大阳极小阴极)控制镀液中三价铬的浓度不至过高。实践证明,镀液中三价铬离子浓度保持在2~7g/L是必要的。
除电解法外,还可使用化学还原法。往镀液中加入某种还原剂,使六价铬离子还原为三价铬。这种方法简单快速,节省成本。还原剂常用草酸、双氧水、乙醇、甲醛等,以双氧水为最佳。方法是每升镀液加双氧水(30%)2~5mL/L即可满足生产要求。
(4)电极反应 水在镀液中离解出氢离子和氢氧根离子:
H2O→2H++OH-
这里的2个氢离子在阴极表面得到2个电子,生成了一个氢分子:
2H++2e→H2↑
这个析氢反应在阴极(镀件)表面不停地进行。这是由于大量氢离子形成了氢气,在阴极表面使OH-离子浓度提高,导致pH值上升。这时,六价铬离子由重铬酸(H2Cr2O7)向铬酸(H2CrO4)转化,便发生了铬的还原反应:
CrO24-+8H++6e→Cr+4H2O
这个反应说明:金属铬是由六价铬离子直接在阴极上被还原出来的。如果镀液中没有硫酸根时,铬的还原反应一瞬间便停止了,不再反应。这是因为:镀铬液中阴极表面还有重铬酸根的还原反应:
Cr2O7-+8H++6e→Cr2O3+4H2O
此反应式与六价铬离子的还原反应相同,这里形成的Cr2O3随着阴极区pH值的上升立即在阴极上生成铬酸铬薄膜[Cr(OH)3Cr(OH)CrO4]。这是一种带正电的胶体,它将阴极表面包裹住,只能让氢离子透过发生析氢反应,而分子尺寸较大的Cr2O7-不能通过,所以,反应一瞬间就停止了。
当镀铬液中含有硫酸等阴离子时,它会与三价铬生成硫酸铬阳离子[CrO(SO4)4(H2O)4]2+,它能溶解阴极表面的铬酸铬薄膜,使Cr2O27-达到阴极表面形成Cr2O42-离子,然后还原出金属铬来。
如果镀铬液中没有三价铬时,也同样不能镀出铬来,这是因为没有三价铬离子,同样不会生成铬酸铬阳离子。所以,三价铬和硫酸都是必不可少的成分。
在镀铬时,成膜与溶膜是在不停地交替进行的。如果硫酸含量低时,成膜速度大于溶膜速度(硫酸作用是溶膜),六价铬还原过程就会受到阻碍,上铬速度就慢,阴极上氢气就析出得多。所以,当镀铬时,发现阴极(镀件)上析出气体较多时,就说明硫酸少了。
在镀铬液中如果硫酸含量较高,溶膜速度就会大于成膜速度,在阴极表面铬和氢气的析出减少,而六价铬还原成三价铬的过程增加,电镀时看到阴极(镀件)上冒出的气泡较少,有时会一股一股地冒出气泡,这就证明镀液中的硫酸含量高了。表2-72归纳了硫酸含量对阴极表面反应的影响。
表2-72 硫酸含量对阴极表面反应的影响

5.镀铬中的阳极
与其他金属电镀不同,镀铬阳极不能使用可溶性的铬金属作阳极,而只能使用不溶性的铅做阳极。如果采用金属铬作阳极会产生两个问题:一是金属铬在镀液中阳极溶解时极其容易,它的阳极电流效率远远大于阴极的电流效率,这样会很快失去平衡,即镀液中还原速度远小于氧化速度,导致铬离子浓度越来越高,直到镀液无法电镀;第二个问题是,阳极溶解时,它主要以三价铬离子形式从金属铬阳极上溶解下来,这很快使镀液中三价铬离子超出工艺规范,同样造成无法继续电镀。
纯铅作阳极时,耐镀液的腐蚀能力较强,尤其是在通电情况下。但断电情况下还是有溶解的。阳极表面会生成铬酸铅或硫酸铅薄膜(黄色),一般要选用铅合金作镀铬阳极,如铅锑合金和铅锡合金阳极。
铅锑合金中锑的质量分数为6%~8%,主要存在于以硫酸作催化剂的镀铬液中,它具有很好的耐蚀性,同时还有增加强度的作用,但它不能用于含氟镀铬溶液中。
锡质量分数为7%的铅锡合金常用在含氟或氟硅酸的镀铬溶液中,具有很好的耐蚀性。在含有有机添加剂的现代镀硬铬溶液中常使用含锡量更高的铅锡合金作阳极,锡质量分数达到15%~30%。
阳极表面在通电时会生成一种棕色的二氧化铅膜,这种膜导电性能好,而且还能防止铬酸对阳极造成的腐蚀。如果在不通电时,阳极泡在镀液中会和铬酸反应生成黄色的铬酸铅膜,这层膜导电能力差,会造成槽电压升高,严重时还会造成阳极不导电。所以,在不生产时,应将阳极取出,泡在净水内。
在电镀时,阳极表面也会冒出气泡,这是电解水的反应:
2H2O-4e→O2↑+4H+
从上式中我们看到,冒出的气泡是氧气。在阳极,镀液中的三价铬离子运动到阳极表面时,它会被氧化成六价铬离子:
Cr3+-3e→Cr6+
在生产中可以利用这一反应来调节镀液中的三价铬含量:当镀液中三价铬离子含量减少时,可以减少阳极面积,增大阴极面积(镀件);当镀液中三价铬离子含量增加时,则增大阳极面积,减少阴极(镀件)面积,使多余的三价铬离子在阳极上氧化成六价铬离子。
除了上述介绍的铅锑合金、铅锡合金等作阳极外,近年来有人发现可以在铅阳极中加入铋金属,它的耐蚀性及强度均比锑好。但它不能消除大量铬酸铅泥渣的形成。
阳极的作用是传导电流,铅的导电能力比铜要差很多,尤其在使用有机添加剂的镀硬铬溶液时,要使用较大的电流,为了导电好,可以在铅阳极中使用铜芯。由于外层包裹铅或铅合金,不会腐蚀铜芯,而铜芯的导电性能比铅好,有利于节电,同时铜芯还能提高阳极的强度,并提供较好的电流分布。
在镀铬过程中,有时要使用辅助阳极,尤其在镀较厚镀铬层时经常用到。辅助阳极的材质大多使用铅或铅锡合金。这种材料在镀液中不会溶解,也易于加工成各种形状。
为了保持镀液中三价铬离子的浓度稳定,有必要保持阳极面积与镀件(阴极)之比为2∶1。
6.镀铬的工艺条件
(1)温度及电流密度对阴极电流效率的影响 当温度固定不变时,阴极的电流效率会随着电流密度的升高而增加。若电流密度保持不变,则阴极的电流效率随着温度的升高而降低。图2-38示出了不同温度下电流密度对电流效率的影响。
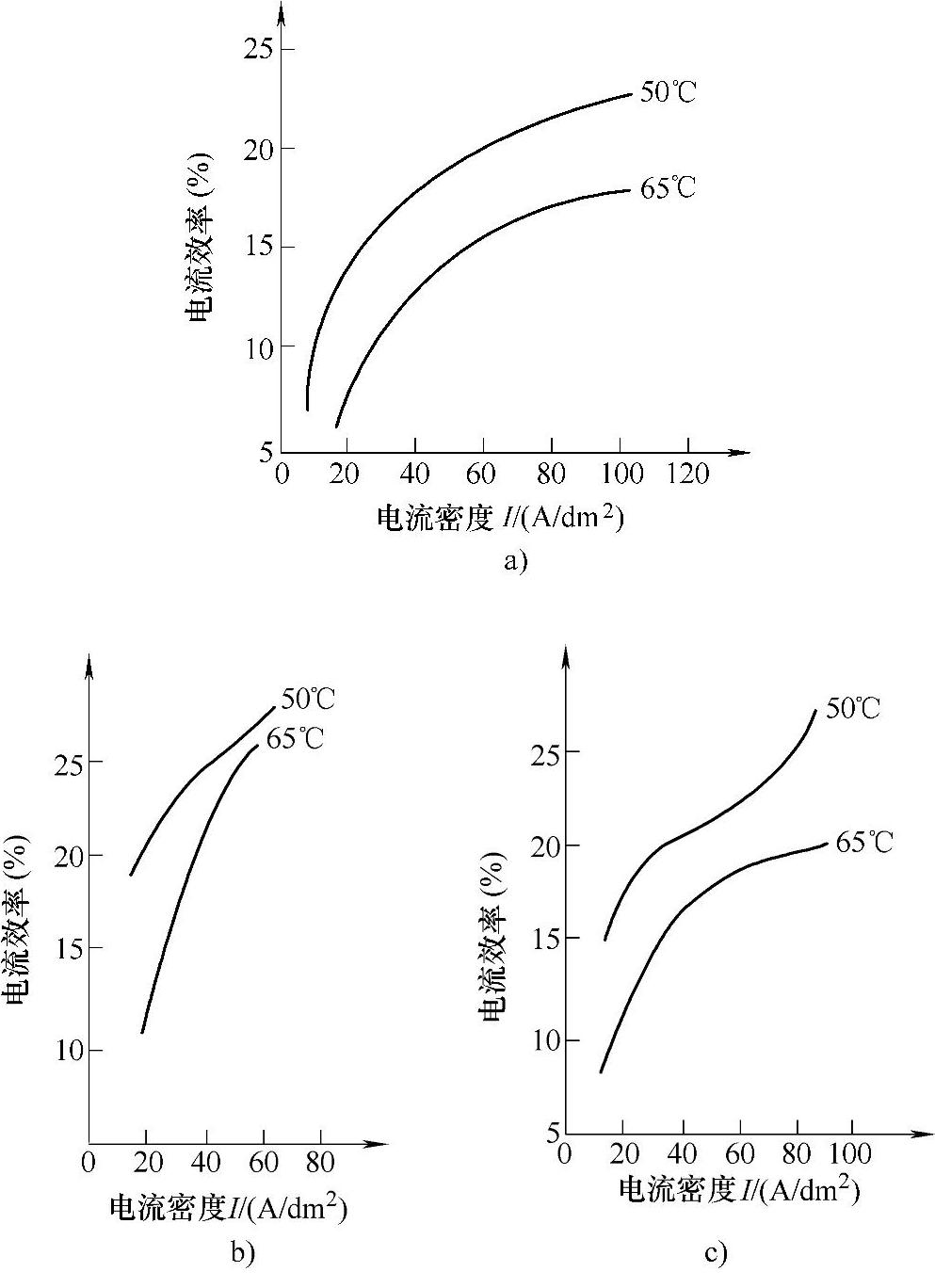
图2-38 不同温度下电流密度对电流效率的影响
a)CrO3250g/L,SO24-2.5g/L b)CrO3250g/L,SO42-1.5g/L,Na2SiF65g/L c)CrO350g/L,SO42-0.5g/L,Na2SiF60.5g/L
(2)温度与电流密度对镀层外观的影响 图2-39示出了温度、电流密度对镀层外观的影响。
图2-39a所示为标准镀铬溶液(CrO3250g/L,H2SO42.5g/L),图2-39b所示为复合镀铬(CrO3250g/L,H2SO41.5g/L,Na2SiF65g/L)。从图中可以看到,两种镀液尽管成分有所不同,但对镀层外观的影响趋势基本相同,即随着温度的升高,电流的光亮区范围越来越宽。在较低温度下,随着电流密度的升高镀层易烧焦,且在50℃后,低电流区没有铬的沉积(镀不上铬),但在稍高电流密度下,都能获得硬度较低、韧性较好且没有裂纹的乳白色镀层。
在中等温度下(40~60℃)及中等电流密度(20~60A/dm2)可获得光亮均匀的镀铬层。所以在标准镀铬时,常选用45~55℃,电流密度为20~60A/dm2下生产。
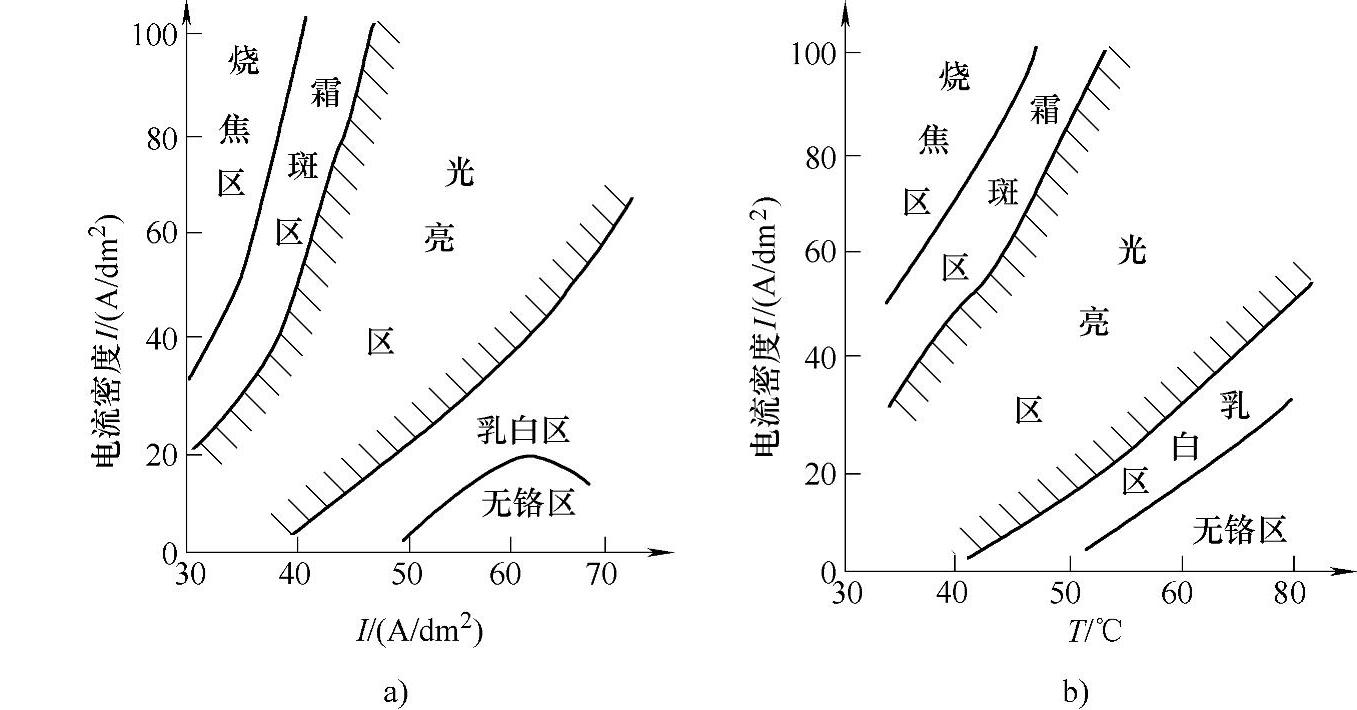
图2-39 温度和电流密度对镀层外观的影响
a)标准铬 b)复合镀铬
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




